Chapitre 1 Risques sanitaires liés aux irradiations. Radioprotection
Plan du chapitre
- I. Nature et sources des radiations ionisantes
- II. Unités utilisées en dosimétrie, radiobiologie et radioprotection
- III. Risques biologiques liés à l'irradiation naturelle ou artificielle
- IV. Radioprotection : définition et principes pour les patients et les personnels
- V. Principes de radioprotection dans le domaine de l'imagerie médicale
- VI. Information des patients
- VII. Applications pratiques et cas particuliers
Situations de départ
- 230 Rédaction de la demande d'un examen d'imagerie.
- 231 Demande d'un examen d'imagerie.
- 232 Demande d'explication d'un patient sur le déroulement, les risques et les bénéfices attendus d'un examen d'imagerie.
Item, hiérarchisation des connaissances
ITEM 180 – Risques sanitaires liés aux irradiations. Radioprotection
| Rang | Rubrique | Intitulé | Descriptif |
| A | Définition | Nature et sources des rayonnements ionisants | |
| A | Définition | Unités utilisées en dosimétrie, radiobiologie et radioprotection | Becquerel, gray, sievert |
| A | Définition | Différents risques | Déterministes et stochastiques |
| A | Définition | Définition de la radioprotection | |
| A | Définition | Principes de radioprotection | Justification, optimisation et limitation |
| A | Définition | Information des patients | |
La radioprotection correspond à l'ensemble des mesures mises en œuvre pour se protéger des effets néfastes reconnus ou potentiels des RI.
En médecine, les mesures de radioprotection concernent tout d'abord les patients et les personnels exposés professionnellement, et s'étendent également au public et à l'environnement en cas d'accident nucléaire. En plus de la gestion du risque physique, la radioprotection en imagerie médicale s'attache également à prendre en compte la dimension psychologique pour ne pas entretenir et au contraire diminuer l'anxiété pouvant être liée à l'exposition aux RI.
I. Nature et sources des radiations ionisantes
A. Nature des rayonnements ionisants
Les RI sont des rayonnements d'énergie suffisante pour éjecter un électron de l'orbite électronique d'un atome. Ils sont électromagnétiques dans le cas des photons X ou γ de masse nulle (utilisés respectivement en radiologie et en médecine nucléaire), ou particulaires lors de l'émission de corpuscules de masse non nulle : rayonnement β+ (utilisé en tomographie par émission de positon : TEP), β– ou α (utilisés en médecine nucléaire à visée thérapeutique).
L'énergie générée par les RI peut entraîner des modifications de la matière vivante, au niveau cellulaire où ces rayonnements induisent des lésions, notamment de l'ADN. Ces effets sur l'organisme varient en fonction de la dose reçue et de différents facteurs : la source (activité ou intensité de fonctionnement, nature, énergie), le mode d'exposition (temps, débit) et la cible (tissus ou organes touchés, âge de l'individu, l'enfant étant plus sensible aux RI).
B. Sources des rayonnements ionisants
Celles-ci peuvent être naturelles ou artificielles :
• il existe quatre modes d'exposition aux sources naturelles de rayonnements ionisants :
– l'irradiation cosmique, due aux photons et aux particules venant de l'espace, très atténuée et modifiée qualitativement en traversant l'atmosphère ;
– l'irradiation tellurique, due aux éléments radioactifs présents dans le sol ;
– l'incorporation d'éléments radioactifs naturels dans l'air ou dans les produits consommés, eau et chaîne alimentaire ;
– l'inhalation de radon, gaz radioactif émanant du sol ;
• l'exposition aux rayonnements artificiels comporte deux grandes catégories :
– l'exposition en rapport avec l'utilisation des RI à des fins diagnostiques et thérapeutiques, traduisant l'exposition « médicale ». Les examens diagnostiques délivrent des doses faibles (< 100 mSv) voire très faibles (< 10 mSv), tandis que les expositions liées à des actes de radiothérapie externe et interne correspondent à de fortes doses (facteur 104 à 105 par rapport aux actes diagnostiques) ;
– l'exposition due à des sources industrielles et militaires : rejets des installations nucléaires, retombées de particules radioactives libérées lors des accidents nucléaires (Tchernobyl ou Fukushima par exemple), tests d'armes nucléaires, sols contaminés lors de l'utilisation de substances radioactives.
Pour la population française, les proportions moyennes des différentes sources d'exposition aux RI sont données dans la figure 1.1.
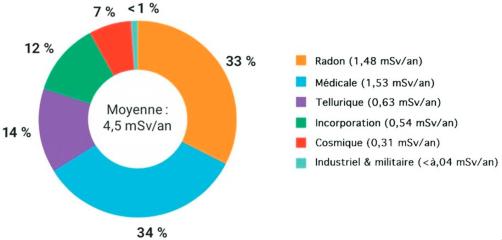
Fig. 1.1.
Source : Rapport IRSN, bilan 2014–2019.
Pour un individu donné, la dose cumulée annuelle (2,4 à 5 mSv) varie en fonction des situations d'exposition (lieu d'habitation, modes de vie, tabagisme, recours à de nombreuses explorations d'imagerie…) et peut, de ce fait, être inférieure voire très supérieure à cette valeur moyenne. L'exposition artificielle a augmenté durant les dernières décennies, notamment en raison du développement des explorations par tomodensitométrie, mais cette variable se stabilise ces dernières années. Par ailleurs, la valeur de l'exposition relative au radon est susceptible d'augmenter prochainement du fait de l'introduction récente d'un nouveau mode de calcul international (prise en compte du coefficient de dose radon CIPR137, 2017).
II. Unités utilisées en dosimétrie, radiobiologie et radioprotection
Les unités employées en radioprotection dérivent du système international. Il est important de savoir utiliser l'unité pertinente pour chaque grandeur mesurée.
• Les grandeurs physiques sont le reflet des interactions physiques des RI avec la matière :
– le becquerel (Bq ou s–1) est l'unité internationale de mesure de l'activité d'un radionucléide, utilisée en médecine nucléaire ; c'est le nombre de transitions nucléaires spontanées par seconde, avec émission d'un rayonnement ionisant. L'activité naturelle du corps d'un adulte de 70 kg est par exemple de 10 000 Bq, celle d'un litre d'eau de mer de 12 Bq et celle d'un kilogramme de granit de 7 000 Bq ;
– le gray (Gy) représente la dose absorbée ; il est utilisé pour mesurer la quantité d'énergie en joules délivrée par un rayonnement dans chaque kilogramme de tissu : 1 Gy = 1 J/kg.
• Les grandeurs dosimétriques évaluent le risque des RI pour la santé. Les grandeurs dosimétriques se classent en deux familles :
– le sievert (Sv) ou son sous-multiple le millisievert (1 mSv = 0,001 Sv), est l'unité de mesure utilisée en radioprotection pour mesurer l'effet biologique d'un rayonnement sur un organisme vivant. C'est une des grandeurs de protection qui sont à la base des limites imposées par les textes réglementaires, notamment pour la protection des travailleurs et de la population générale. Elles ne sont pas directement mesurables et reflètent le préjudice potentiel pour la santé du fait d'une exposition interne et/ou externe aux RI. Elles comprennent la dose équivalente à l'organe, prenant en compte le type de rayonnement, importante pour connaître les organes à risque lors d'une procédure donnée, et la dose efficace qui est calculée par une pondération sur le corps entier. Cette unité permet donc de comparer l'effet d'une même dose délivrée par des rayonnements de nature différente à des organismes, des organes ou des tissus qui n'ont pas la même sensibilité aux rayonnements ;
– il existe par ailleurs des grandeurs opérationnelles : en radiodiagnostic, des grandeurs dosimétriques spécifiques sont utilisées, telles que le produit Dose × Surface (PDS) pour l'imagerie de projection, qui s'exprime en mGy·cm2, l'index de dose scanographique volumique (IDSV, ou CTDI pour l'acronyme anglais) qui tient compte du profil de coupe en tomodensitométrie (TDM, ou scanner) ; celui-ci ne reflète pas directement la dose totale reçue par le patient, cette dernière étant exprimée par le produit Dose × Longueur (PDL) qui permet de représenter l'exposition en multipliant l'IDSV par la longueur totale explorée, parfois en plusieurs acquisitions ; le PDL s'exprime en mGy·cm. PDS et PDL permettent, en prenant en compte la région anatomique exposée, d'estimer la « dose efficace » elle-même exprimée en millisieverts.
III. Risques biologiques liés à l'irradiation naturelle ou artificielle
A. Deux types d'effets des rayonnements ionisants
1. Effets précoces
Les effets précoces (ou déterministes) sont dus à l'effet physique de l'exposition aux rayonnements ionisants et sont la conséquence de la mort cellulaire induite. Ils sont quantifiables en fonction de la dose absorbée. Ils apparaissent toujours au-delà d'une dose-seuil connue (environ 200 mGy) et leur gravité augmente avec la dose reçue. Ils peuvent engager le pronostic vital en irradiation globale (pour une irradiation du corps entier unique de 5 Gy, la mortalité est de 50 %) et peuvent avoir des conséquences fonctionnelles lourdes en cas d'irradiation partielle (alopécie, brûlures). En imagerie, seules la radiologie interventionnelle et la radiothérapie interne vectorisée en médecine nucléaire exposent le patient à des doses suffisantes pour créer un risque déterministe. Ceci est également le cas de la radiothérapie externe. Le traitement des lésions tardives (fibrose, cataracte) étant difficile et peu efficace, il faut donc tout mettre en œuvre pour les prévenir, par la connaissance et le respect des doses limites, ce qui nécessite une dosimétrie précise lors des gestes réalisés.
2 Effets tardifs
Les effets tardifs (aléatoires ou stochastiques) sont liés à des lésions cellulaires, en particulier (mais pas seulement) à des mutations ponctuelles radio-induites de l'ADN qui peuvent aboutir à la survenue d'affections malignes. Le risque de survenue est apprécié à partir de l'impact biologique supposé, exprimé en Sv. Le délai d'apparition après l'exposition est de plusieurs années. Une affection radio-induite n'a pas de signature particulière reconnue : absence de marqueur biologique permettant de différencier, par exemple, un cancer pulmonaire dû au tabac d'un cancer pulmonaire radio-induit. La probabilité d'apparition d'un cancer radio-induit est fonction de la dose de l'exposition aux rayonnements ionisants, selon une relation linéaire au-dessus de 100 mSv, mais elle est très débattue pour les doses plus faibles (présence de nombreux mécanismes de défense cellulaire, tissulaires et immunologiques limitant la prolifération tumorale).
B Épidémiologie des risques liés aux principaux examens radiologiques et aux actes interventionnels
1 Risque déterministe
Dans le cadre des explorations en imagerie, celui-ci concerne essentiellement la peau et le cristallin. La peau peut recevoir une dose supérieure à 3 Gy au cours de certaines procédures interventionnelles, nécessitant des précautions spécifiques pendant la réalisation du geste et lors du suivi du patient. Le cristallin est l'organe le plus sensible, avec un risque de cataracte (seuil entre 0,5 et 2 Gy). Cet aspect doit être pris en compte pour le patient là encore lors de procédures spécifiques, mais également pour l'opérateur de radiologie interventionnelle du fait des doses cumulées.
Le risque déterministe est également responsable de la survenue d'éventuelles malformations fœtales au cours de l'embryogenèse. La période maximale de sensibilité est comprise entre le 9e jour et la 9e semaine de grossesse, pour une dose supérieure à 100 mSv. Il existe également un risque de retard mental lorsque l'exposition cérébrale survient avant la 25e semaine.
2 Risque carcinogène
Les études épidémiologiques ont montré avec certitude que le risque de cancer augmente de manière significative chez les personnes ayant reçu une dose de RI supérieure à 100 mSv. Les RI à forte dose et débit de dose élevé ont un effet cancérogène indubitable mais relativement faible par rapport aux autres cancérogènes naturels ou artificiels, ce qui rend difficile leur individualisation dans une population donnée, en sachant que le risque carcinogène global « vie entière » est actuellement estimé à 25 % dans la population générale, et que d'autres facteurs peuvent intervenir (exposition à d'autres oncogènes, sensibilité individuelle particulière). Les effets sur le génome, éventuellement transmissibles à la descendance, ne sont pas établis chez l'homme et sont probablement négligeables par rapport au nombre d'altérations génétiques spontanées.
Pour les faibles doses, à l'heure actuelle, les effets sur la santé humaine d'une exposition à des doses inférieures à 100 mSv font l'objet de débats scientifiques. C'est d'ailleurs pourquoi cette valeur de 100 mSv a été choisie pour définir schématiquement le domaine des « faibles doses ». Des études d'importantes cohortes pédiatriques (> 100 000 patients) permettraient de mieux apprécier ce risque, mais elles sont d'analyse difficile compte tenu de nombreux biais.
Une relation linéaire décrit convenablement la relation entre la dose et l'effet cancérogène pour les doses supérieures à 200 mSv (suivi des grandes populations irradiées par les bombes atomiques en 1945). Bien que ce risque n'ait été véritablement démontré et accepté par l'ensemble des chercheurs que pour les fortes doses, il est considéré, par principe, que les effets stochastiques peuvent survenir après toute exposition aux rayonnements ionisants, même si ce risque n'est véritablement démontré que pour les fortes doses. En radioprotection, pour estimer l'ordre de grandeur du risque encouru par les travailleurs et dans une optique sécuritaire maximale, un modèle volontairement pessimiste, dit de relation linéaire sans seuil (RLSS), est utilisé. Il donne la certitude de ne pas sous-estimer ce risque, s'il existe. Cette RLSS constitue un risque plafond utilisé à des fins de radioprotection pour les travailleurs exposés, mais elle ne peut en aucun cas être utilisée pour calculer la probabilité d'induction d'effets stochastiques des faibles doses dans la population générale. Comme signalé précédemment, le fondement scientifique de la RLSS en dessous de 100 mSv est fortement remis en question. Légitime pour la radioprotection des travailleurs, elle n'est pas utilisable pour prédire chez un sujet donné un risque après une exposition à faible dose.
En dehors des procédures de radiologie interventionnelle, les doses délivrées par la plupart des examens radiologiques et de médecine nucléaire sont inférieures voire de l'ordre d'une dizaine de mSv. Les rayonnements ionisants auxquels sont exposés les travailleurs ou les personnes habitant les régions où l'irradiation naturelle est élevée sont également de cet ordre. Le seul risque à prendre en compte en imagerie médicale diagnostique, pour le patient (toujours faibles doses < 100 mSv) et pour le personnel ou le public (très faibles doses < 10 mSv), concerne donc essentiellement le risque aléatoire de cancérogenèse radio-induite même si ce dernier est actuellement essentiellement théorique.
3. Risque mutagène
Les effets sur le génome (action potentielle sur l'ADN des cellules germinales), éventuellement transmissibles à la descendance, ne sont pas établis chez l'homme et sont probablement négligeables par rapport au nombre d'altérations génétiques spontanées.
IV. Radioprotection : définition et principes pour les patients et les personnels
La radioprotection recouvre l'ensemble des mesures prises pour assurer la protection de l'homme et de son environnement contre les effets des rayonnements ionisants. Elle s'est construite progressivement depuis la découverte de la radioactivité au début du XXe siècle. L'amélioration continue de la protection radiologique des professionnels et du public a permis de constater ces dernières années que les personnes les plus exposées dans notre société étaient maintenant les patients.
La transposition en droit français des directives européennes, en particulier la dernière en date (directive 2013/59 Euratom), fixant les normes de bases relatives à la protection sanitaire contre les dangers liés à l'exposition aux RI, a modifié de façon importante la prise en compte de la radioprotection dans la pratique médicale. Les modifications inscrites dans les codes de la santé et du travail (décrets n° 2018-434, 436 et 437 du 4 juin 2018) portent sur la radioprotection des patients et des personnels, la réglementation de la conception, de l'installation et de la signalisation des locaux et des dispositifs utilisant des RI, ainsi que sur les procédures de contrôle de qualité ; il a été instauré une obligation de formation initiale et continue à la radioprotection des patients pour tous les utilisateurs de RI, applicable à tous les médecins.
L'usage des RI dans le domaine du diagnostic médical ne peut se voir appliquer de limites réglementaires individuelles pour la dose car les bénéfices qu'il apporte sont très supérieurs aux risques qu'il peut engendrer, à condition que l'examen soit justifié (on parle de façon plus large de pertinence de l'examen) et d'une qualité suffisante pour le diagnostic, introduisant ainsi les grands principes régissant la radioprotection dans le domaine médical.
V. Principes de radioprotection dans le domaine de l'imagerie médicale
La justification des examens d'imagerie constitue le premier de ces principes. Elle consiste à établir le bénéfice net d'un examen par rapport au préjudice potentiel lié à l'exposition aux RI. Pour permettre son application, le code de la santé publique dispose « qu'aucun acte exposant aux RI ne peut être pratiqué sans un échange préalable d'information écrit entre le demandeur et le réalisateur de l'acte. Le demandeur fournit au réalisateur les informations nécessaires à la justification de l'exposition demandée dont il dispose. Il précise notamment le motif, la finalité, les circonstances particulières de l'exposition envisagée, notamment l'éventuel état de grossesse, les examens ou actes antérieurement réalisés… ». Le guide du bon usage des examens d'imagerie (https://aderim.radiologie.fr/home) édicté par la Société française de radiologie et la Société française de médecine nucléaire sous l'égide de l'Autorité de Sûreté nucléaire et de la Haute Autorité de Santé constitue un document support important pour la mise en œuvre de ce principe. La connaissance des indications des principaux examens d'imagerie en fonction de la situation clinique est fondamentale pour tout médecin. L'application du principe de justification doit également tenir compte d'une possible substitution par un examen non irradiant, telles l'échographie ou l'IRM, en cas de performance diagnostique égale et de disponibilité adéquate. Les indications des examens d'imagerie fournies dans chaque chapitre du présent ouvrage sont en accord avec ce guide.
Le deuxième principe concerne l'optimisation des pratiques par l'opérateur utilisant les RI. Elle consiste à réaliser un acte irradiant au moindre coût radiologique pour une performance diagnostique ou thérapeutique maximale, pour maintenir la dose à un niveau le plus bas que raisonnablement possible selon l'acronyme anglais ALARA (As Low As Reasonably Achievable). La prise en compte de la qualité diagnostique est pertinente, l'acronyme devenant alors ALADA (As Low As Diagnostically Acceptable). L'optimisation s'applique pour l'ensemble des patients et des examens irradiants, en particulier pour les jeunes enfants compte tenu de leur plus grande radiosensibilité. L'application de ce principe passe par l'obligation de maintenance et d'assurance de qualité des matériels, l'obtention d'un diplôme attestant du suivi d'une formation à la radioprotection des patients et la prise en compte des niveaux de références diagnostiques (NRD) ; ces derniers ont pour but de décrire l'exposition observée pour les examens les plus courants et de permettre à chaque professionnel, par comparaison, une évaluation de ses pratiques. Il est obligatoire de stipuler dans le compte rendu d'examen d'imagerie tous les éléments nécessaires à l'évaluation de la dose délivrée au patient : PDS en radiographie standard ou interventionnelle, PDL en TDM en précisant le champ exploré (et IDSV pour les examens abdominopelviens chez la femme), nature du radiopharmaceutique et activité injectée en médecine nucléaire.
Le troisième principe concerne les personnels professionnellement exposés et consiste au contrôle et à la limitation des doses reçues. Chaque professionnel doit être conscient de son environnement technique et responsable des personnels qui l'accompagnent. Se protéger est un gage de sérénité autant qu'une obligation réglementaire. La démarche d'optimisation pour le patient bénéficie directement aux personnels. Sur le plan réglementaire et dans le cadre de la médecine du travail, les personnels exposés aux RI bénéficient d'une réglementation propre aux lieux et conditions de travail ainsi que d'un suivi (dosimétrie passive et/ou opérationnelle) et d'une catégorisation professionnelle avec une limitation annuelle fixée à 20 mSv en dose efficace annuelle délivrée au corps entier pour la catégorie A et 6 mSv pour la catégorie B. En cas de grossesse chez une professionnelle, la dose totale ne doit pas dépasser 1 mSv pour la période située entre la déclaration de grossesse et l'accouchement, ce qui peut nécessiter une adaptation du poste de travail et le port d'un dosimètre opérationnel. Dans le cadre de cette catégorisation, la dose maximale au public a été fixée à 1 mSv par an, alors même que l'irradiation naturelle moyenne en France se situe entre 2,4 et 5 mSv. Enfin, nous rappelons que cette limitation de dose ne concerne pas les patients.
VI. Information des patients
La population générale a un faible niveau de connaissances concernant les effets des RI et plus généralement des données scientifiques. Dans le cadre du devoir d'information du patient, il faut rappeler qu'en imagerie médicale, aucune procédure diagnostique n'atteint 100 mSv, ce qui signifie que ces procédures sont réalisées dans une plage de doses pour laquelle aucun effet déterministe ne peut survenir. L'augmentation « à la marge » de l'incidence de cancers pour une exploration donnée reste très discutée, issue de modèles statistiques présomptifs ou portant sur des données d'études rétrospectives épidémiologiques, souvent de type cas-témoins, d'interprétation parfois difficile.
Il convient avant tout de rassurer les patients et leurs familles en ne faisant pas l'amalgame entre risques réels et risques supposés et en centrant cette information sur la balance bénéfices (avérés, objectifs des RI pour le diagnostic médical)/risques (théoriques des RI aux faibles doses).
La connaissance des échelles de doses efficaces moyennes délivrées par tel ou tel examen (tableau 1.1) comme rappelées dans le guide du bon usage et surtout leur comparaison avec les niveaux d'exposition naturelle annuelle (2,9 mSv en France, variant dans le monde de 1 à 150 mSv : Inde, Iran) permettent de relativiser concrètement l'exposition médicale et son niveau de risque.
Tableau 1.1.
| Examens en imagerie et autres valeurs seuils | Dose efficace | Équivalent irradiation naturelle |
| Radiographie des poumons | 60 μSv | 1 semaine |
| Vol transatlantique | 50 μSv | 1 semaine |
| Cystographie chez un enfant entre 1 et 5 ans | 0,2 mSv | 1 mois |
| Tomodensitométrie du crâne | 2 mSv | 9 mois |
| Irradiation naturelle moyenne en France par an | Entre 2,4 et 5 mSv | |
| Scintigraphie osseuse | 5 mSv | 2 ans |
| TDM abdominopelvienne | 10 mSv | 3 à 4 ans |
| Limite d'exposition des travailleurs catégorie A par an | 20 mSv | |
| Seuil au-delà duquel les effets stochastiques sont prouvés | 100 mSv | |
| Seuil de myélotoxicité | 1 Sv | |
| Seuil de toxicité digestive | 5 Sv | |
| Seuil d'apparition des radiodermites | 10 Sv | |
| Seuil de neurotoxicité | 20 Sv | |
| Dose d'une radiothérapie ciblée sur une tumeur | 50 Sv |
Doses valables en 2019, variables en fonction des appareils et réglages, susceptibles d'évoluer.
Source : CERF, CNEBMN, 2022.
VII. Applications pratiques et cas particuliers
En médecine nucléaire diagnostique, où le patient va émettre lui-même pendant quelque temps de très faibles doses de RI, aucune mesure d'éviction particulière n'est recommandée pour l'entourage et les sujets contacts, y compris les enfants en bas âge et les femmes enceintes, les doses cumulées étant toujours très inférieures à 1 mSv et très souvent équivalentes à celles délivrées par l'irradiation naturelle de certaines régions sur quelques jours.
En radiologie interventionnelle, les patients doivent être informés en aval du geste de la nécessité d'un suivi cutané (au moins 3 mois), lorsque certaines procédures ont délivré de fortes doses de RI (pouvant être supérieures 3 Gy à la peau). Le risque d'érythème, d'alopécie voire de lésions cutanées plus graves ne doit pas être négligé et doit être également signalé au correspondant clinicien.
Chez l'enfant, du fait de la plus forte radiosensibilité, la vigilance doit être accrue tant sur la justification des actes que sur l'optimisation des pratiques. Les possibilités de substitution par une échographie ou une IRM sont capitales à prendre en compte. La balance bénéfices/risques doit toujours être appréciée, avec une coopération entre clinicien et imageur. Les explications fournies aux parents sont essentielles à leur information et à leur adhésion, permettant une prise en charge adéquate du petit patient.
Enfin, la grossesse constitue un cas particulier tant il apparaît que la relation entre exposition médicale et grossesse est fortement empreinte d'angoisse et de subjectivité. Pourtant, comme pour les autres situations, la présentation objective des risques réels et des effets possibles permet d'éliminer toute forme d'angoisse à ce sujet en centrant le discours sur la balance bénéfices/risques. Il convient de rappeler que les malformations congénitales radio-induites relèvent des effets déterministes au-delà d'un seuil et ne peuvent pas survenir en deçà de 100 mSv, alors que le risque « naturel » de survenue d'une malformation congénitale est de 3 %, de même que pour le retard mental. Ceci n'empêche pas d'appliquer les deux grands principes de radioprotection que sont la justification et l'optimisation, tout particulièrement chez les femmes enceintes ou susceptibles de l'être, nécessitant la recherche systématique d'une grossesse potentielle chez toute femme en capacité de procréer avant de réaliser un acte comportant des radiations ionisantes. Une vérification rapide de la dose délivrée à l'utérus en cas d'exposition abdominopelvienne et de grossesse méconnue doit permettre dans l'immense majorité d'être parfaitement rassurant.
Points clés
• La radioprotection correspond à l'ensemble des mesures mises en œuvre pour protéger des effets néfastes reconnus ou potentiels des rayonnements ionisants.
• Les grandeurs physiques (becquerel, grey) sont le reflet des interactions physiques des rayonnements ionisants avec la matière, tandis que les grandeurs dosimétriques (sievert, PDL, PDS, CTDI) évaluent le risque des rayonnements ionisants pour la santé.
• Les effets précoces (ou déterministes), dus à l'effet physique de l'exposition aux rayonnements ionisants, sont la conséquence de la mort cellulaire induite.
• Les effets tardifs (aléatoires ou stochastiques), liés à des lésions cellulaires, peuvent aboutir à la survenue d'affections malignes.
• Les grands principes de radioprotection sont la justification, l'optimisation et la limitation.

